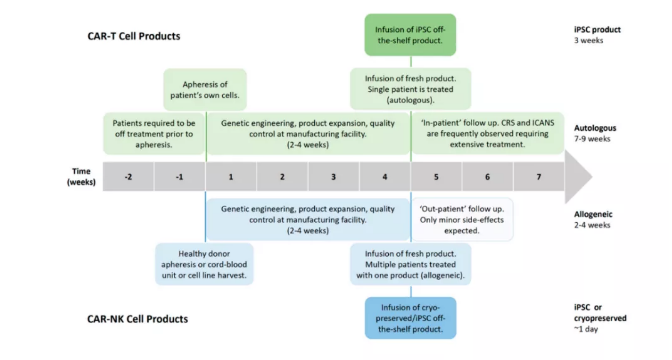
第二代自体CD19靶向CAR-T细胞的成功临床试验获得FDA批准。这些产品目前的局限性是与CAR-T细胞疗法相关的制造时间和成本以及严重的毒性。从化学治疗难治性患者产生自体CAR-T细胞产物受到所获得T细胞质量以及患者自身生存时间的严重限制,因为制造过程需要2-4周(图2)。此外,患者在单采前必须进行两周的不治疗,以确保其在生产过程中具有足够的细胞数量和活力。
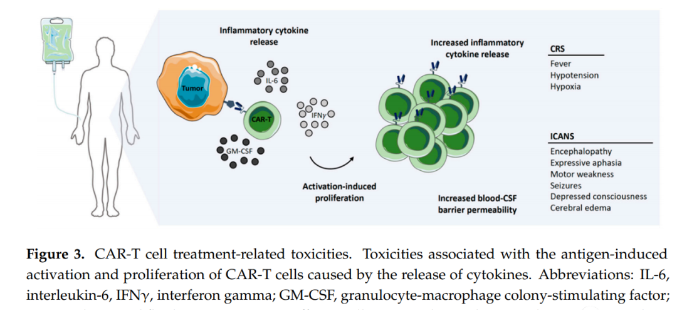
经常观察到神经毒性,免疫细胞相关的神经系统综合症(ICANS)和细胞因子释放综合症(CRS),它们都是严重的疾病,如果不加以治疗可能会致命,特别是在CRS的情况下(图3)。
NK细胞的安全性及其抗肿瘤潜力,使它们成为实施CAR技术的有希望的细胞类型,可将其细胞毒性潜力重定向至特定靶标。生产可以普遍治疗患者的现成的CAR-NK细胞产品的可行性将显着提高给药速度,有效地减少从决定治疗和首次给药到1天的延迟时间。由于没有观察到或预期到CAR-NK细胞会产生严重的毒性,可通过“门诊”随访监测进行治疗,从而显着降低了因长期住院治疗而与CAR-T细胞疗法相关的巨大间接成本。
虽然诱导多能干细胞(iPSC)衍生的CAR-T细胞产物也可以作为现成的产物生产,但需要额外的基因修饰以去除内源性TCR,从而生产通用的产物而无需HLA匹配。尽管如此,通过使用iPSC衍生的CAR-T细胞并不能消除从CAR-T细胞疗法中观察到的严重副作用,这仍然需要治疗后的住院治疗。
最近对全球正在进行的临床试验进行的荟萃分析确定了520项有效试验,共检查了64种不同的CAR,其中96.4%的试验使用CAR-T细胞。因此,就将实验室研究转化为临床环境而言,CAR-NK细胞领域仍处于起步阶段。
在血液中,细胞毒性CD56dim NK细胞和免疫调节性CD56bright NK细胞构成了NK细胞的两个主要种群。与T细胞相比,NK细胞对基因工程具有相当的抵抗力,并且由于它们可以经历的细胞分裂数量有限,因此很难扩增为输注所需的大量细胞。为了缓解这些挑战,许多早期CAR-NK细胞研究已经用NK细胞系代替从脐带或外周血获得的原代NK细胞进行了研究。
NK细胞系(NK-92)
迄今为止,大多数CAR-NK细胞研究都是使用NK-92细胞进行的,包括大量当前的临床试验(表1)。尽管NK-92细胞在表型上类似于血液中发现的免疫调节且细胞毒性较弱的CD56bright种群,但它们在功能上具有高度细胞毒性。
它们的激活受体库包括NKp30,NKp46和NKG2D,它们的抑制库仅限于低水平的ILT-2,NKG2A和KIR2DL4。细胞表面缺乏抑制性杀伤免疫球蛋白样受体(KIR)的表达,以及由于CD16表达低或不存在而无法通过抗体依赖性细胞毒性(ADCC)杀伤,大大区别了该细胞系与原代NK细胞。
这些缺陷导致将NK-92细胞进行基因工程改造以表达高抗体CD16受体,并合理地将表达CD16的NK-92细胞与抗肿瘤单克隆抗体结合在一起,以促进通过ADCC消除肿瘤。此外,相比于未修饰的NK-92细胞响应靶标暴露的相对较低的产量,许多研究都过度表达CAR的NK-92细胞中的IFN释放增加。
开发基于细胞系的CAR产品带来的优势是无限的增殖能力,并降低了对反复冷冻/融化循环的敏感性。这些特性允许制造通用的现货产品,从而大大减少了制造时间和成本。相反,基于细胞系的产品提出了新的安全性问题,NK-92细胞具有许多遗传异常,并有在输注后永久移植的潜力,因此绝对需要在输注前进行照射。大量研究表明,NK-92细胞在辐照后仍具有细胞毒性,但是缺乏体内增殖,会导致仅在7天后清除注入的细胞。因此,使用基于NK-92的CAR产品进行治疗很可能需要多轮输注。
脐带血NK细胞
从脐带血(CB)中分离出的NK细胞为CAR-NK产品提供了另一种可能的原料。CB淋巴细胞中有15%至30%是NK细胞,与外周血(PB)NK细胞相比,通常认为它们在表型和功能上更为幼稚。
据报道,CD16,颗粒酶B,穿孔素和KIR的表达降低,以及细胞粘附分子(包括CD2,CD11a,CD18和CD62L)的表达降低。通过KIR表达,有限的ADCC潜力和有限的功能成熟,以及粘附分子的减少,都有助于在该细胞群中观察到的降低的细胞毒性能力。
较高百分比的CB NK细胞为CD56bright,有助于抑制受体NKG2A的整体表达,该配体的HLA-E配体通常在肿瘤细胞上调,并且与不良预后相关。因此,NKG2A是重要的抑制性检查点,已被单克隆抗体疗法作为靶点,以释放头颈部鳞状细胞癌中NK细胞的潜能。与它们的不成熟特性一致,CB NK细胞具有更高的增殖能力,并且非常容易受到细胞因子的刺激。脐带血库使源自CB的NK细胞成为可行的起始产物,而从脐带血中获得的小体积则要求NK细胞经历大量的细胞分裂,然后才能获得足够的输液所需的细胞数。尽管如此,临床的CAR-NK细胞产品还是由CB NK细胞制成,目前正在临床中进行测试。
外周血NK细胞
大约90%的外周血NK细胞是具有细胞毒性的CD56dim NK细胞,可表达大量的抑制和激活受体。与CB NK细胞相比,PB NK细胞更成熟,导致功能增强,但增殖能力降低。在自体和同种异体环境下,来自匹配和HLA不匹配的NK细胞,以及匹配和KIR-配体不匹配的供体。使用来自不相关的HLA不匹配供体的细胞的可能性大大增加了可供选择的供体的数量,因此可以显着提高最终产品的质量。Apheresis是一种从健康供体血液中提取有核细胞的方法,通常通过CD3和CD19耗竭,有助于分离足够数量的NK细胞,然后通常通过细胞因子(例如,输注前IL-2或IL-15。尽管针对造血系统恶性肿瘤(主要是AML)的临床结果令人鼓舞,但临床反应已针对患者,并且难以根据临床前的体外研究进行预测。
iPSC衍生的NK细胞
NK细胞的第四个也是相当近期的来源是iPSC衍生的NK(iNK)细胞。iPSC衍生的NK细胞由于其无限的增殖潜力而成为现成的CAR-NK细胞产品的理想来源。相比之下,转导效率在制造CB或PB衍生的CAR-NK细胞中起着重要作用,并且仅需一个CAR诱导的iPSC细胞即可产生通用的现成CAR-NK细胞产物。但是,iPSC衍生的NK细胞仍处于起步阶段,要想生产出理想的现成产品,仍需要克服许多挑战。iPSC通常来自非造血细胞,例如成纤维细胞,产生的iNK细胞具有不成熟的表型,其特征是CD16表达低,NKG2A表达高,KIR表达低于PB NK细胞。这就提出了一个问题,即在遇到靶细胞后如何维持和释放它们的溶细胞潜力,这可以通过表达CAR构建体来解决。
与NK-92细胞类似,对iNK细胞进行基因工程改造以表达其缺乏的表面蛋白(例如CD16)是解决当前限制的一种潜在方法。尽管它们的增殖能力是无与伦比的,但在利用iPSC衍生的NK细胞的真正潜能之前,仍然需要解决输注后持续存在的问题。
第一个iPSC衍生的CAR-NK细胞产物FT596表达CD19-CAR构建体和高亲和力,不可裂解的CD16 Fc受体以及IL-15受体融合蛋白,并将与CD20-定向单克隆抗体治疗。
因此,该产品不仅解决了有限的持久性,而且还解决了iNK细胞CD16的低表达问题,并将组合免疫疗法付诸实践。来自CD19+淋巴瘤的人源化小鼠体内研究的有希望的临床前结果为最近列出的I期临床试验(NCT04245722)铺平了道路。

