mRNA疫苗已经成为肿瘤免疫治疗的一个很有前途的平台。在疫苗接种过程中,mRNA疫苗可在抗原提呈细胞(APC)中高效表达肿瘤抗原,促进APC活化和天然/获得性免疫应答(图1)。mRNA肿瘤疫苗以其高效、安全、快速的发展潜力和高性价比等优势领先于其他常规疫苗平台。然而,mRNA疫苗的应用受到不稳定、天然免疫原性和体内递送效率低下的限制。目前已通过各种策略来克服这些问题,例如适当的mRNA结构修饰(密码子优化、核苷酸修饰、自我扩增mRNAs等),以及配制方法(脂质纳米粒(LNP)、聚合物、多肽等)。调整给药途径,将多种mRNA疫苗与其他免疫治疗药物(如检查点抑制剂)联合应用,进一步增强了宿主的抗肿瘤免疫能力。随着FDA最近批准LNP mRNA疫苗用于预防新冠肺炎,以及mRNA癌症疫苗在多个针对多种实体瘤的临床试验中取得了良好的治疗效果,可以预见,在不久的将来,用于癌症免疫治疗的mRNA疫苗将迅速发展并为患者服务。
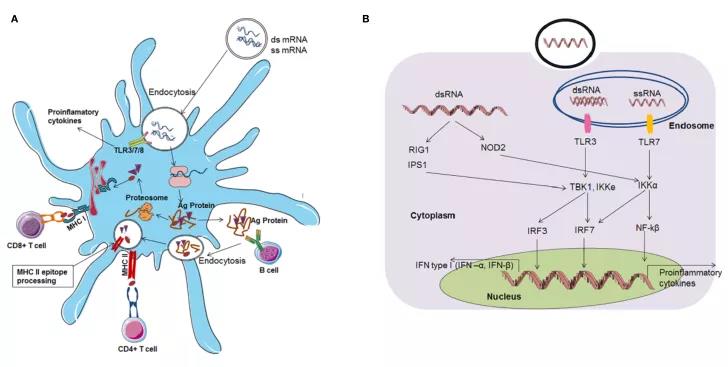
图1. 基于mRNA疫苗的适应性免疫应答和先天性应答
目前四种类型的癌症疫苗,包括基于肿瘤或免疫细胞的疫苗、基于多肽的疫苗、基于病毒载体的疫苗和基于核酸的疫苗。基于核酸(DNA或RNA)的疫苗是一种很有前途的疫苗平台。首先,核酸疫苗允许同时传递覆盖各种TAA或体细胞肿瘤突变的多个抗原,同时激发体液和细胞介导的免疫反应,增加克服疫苗耐药性的可能性。其次,与多肽疫苗不同,核酸疫苗可以编码全长的肿瘤抗原,允许APC同时呈现或交叉呈现I类和II类患者特异性人类白细胞抗原(HLA)的多个表位,因此不受人类HLA类型的限制,更有可能激发更广泛的T细胞反应。mRNA相对于DNA的优势包括:(1) mRNA既可以在分裂细胞中翻译,也可以在非分裂细胞中翻译,只需要内化到细胞质中,然后一步翻译成感兴趣的抗原。mRNA的蛋白表达率和表达量通常高于DNA疫苗。(2)与DNA疫苗不同的是,mRNA疫苗不能整合到基因组序列中,因此没有插入突变。(3)mRNA肿瘤疫苗的另一个优点是生产速度快、可扩展。成熟的mRNA制造工艺和制剂平台可以在很短的时间内生产出一种新型疫苗。
将mRNA转染DC过继转移是第一个进入临床试验的基于mRNA的治疗性肿瘤疫苗。基于DC的mRNA疫苗疗法仍然占据了临床试验中的mRNA肿瘤疫苗的大部分,最近由非病毒载体IVT mRNA免疫疗法得到了广泛的探索,在临床研究中也获得了积极的抗肿瘤效果。CureVac、BioNTech和Moderna是该研究的先行者。
编码免疫刺激剂的mRNA
免疫刺激剂通常是细胞因子或趋化因子,它们诱导APC成熟和激活,激活T细胞介导的免疫,并调节功能失调的免疫肿瘤微环境。瘤内、结内、皮内和静脉给药已用于 mRNA 编码免疫刺激剂,目前大多数处于 I/II 阶段以评估耐受性。
该领域的先驱之一是eTheRNA。该公司已经开发出一种基于TriMix mRNA的佐剂,它由三个裸mRNA分子组成,编码共刺激分子CD70来诱导CD8+T细胞的激活,编码CD40L来激活CD4+T细胞,以及TLR4来促进DC抗原递呈。在多个临床试验中评估的裸TriMix mRNA和体外DC负载的TriMix mRNA具有良好的耐受性和免疫原性。将编码TAAs的mRNA(如MAGE-A3、酪氨酸酶、gp100和Melano-A/MART-1)和TriMix mRNA导入DC(体外或原位),可以将它们重新编程为成熟的APC,随后启动T细胞的功能。在治疗III/IV期黑色素瘤患者的两项第二阶段研究中,无论是作为单独的产品(TriMix mRNA加TAA mRNA,即TriMixDC-MEL),还是与CTLA-4阻断的单克隆抗体ipilimumab检查点抑制剂联合使用,都能够引发强大的免疫反应,显示了良好的临床效果 (NCT01676779,NCT01302496)。
另一家先驱公司Moderna已经开发出两种封装在LNP平台中的mRNA产品,用于肿瘤内的免疫刺激。这两种产品目前正在进行I期临床试验,以确定重复给药的安全性和耐受性。其中一种产品是mRNA-2416,使用编码OX40L的mRNA,单独给药或与静脉注射联合使用PD-L1抑制剂duvalumab治疗淋巴瘤和转移性卵巢癌(NCT03323398)。另一种是mRNA-2752,由治疗淋巴瘤的OX40L/IL-23/IL-36 mRNA组成(NCT03739931)。在mRNA-2752鸡尾酒中,OX40L合成次级信号,增强T细胞效应器的功能,促进T细胞的扩增和存活。IL-36作为促炎细胞因子发挥作用,进一步增强抗癌反应。IL-23(IL-12家族成员)可作为天然免疫和获得性免疫的中枢协调者。Moderna正在与阿斯利康合作,并计划通过瘤内注射开发MED I1191(IL-12 mRNA)。BioNTech的阳离子脂质体负载BNT151(核苷修饰的IL-12mRNA)也在通过静脉注射扩增疫苗诱导的T细胞应答方面进行临床前评估。
编码肿瘤相关抗原的mRNA疫苗
开发有效的癌症疫苗的关键障碍之一是抗原选择的困难。癌症疫苗可以被设计成针对在恶性肿瘤细胞中优先表达的TAA。例如,酪氨酸酶、gp100、MAGE-A3、MAGE-C2已被确定为黑色素瘤的TAA。在多项临床研究中,编码该TAAs的mRNA疫苗的鸡尾酒疗法已经用于治疗转移性黑色素瘤。
该领域一个知名的例子是Lipo-MERIT。Lipo-MERIT是通过将mRNA与阳离子脂质(如DOTMA或DOTAP)络合而制成的。阳离子脂质:mRNA的比例为1.3:2的脂质体可有效靶向小鼠脾脏树突状细胞,并能激活NK、B、CD4+、CD8+T细胞,在多种小鼠肿瘤模型中具有较强的免疫治疗作用,并已应用于临床。在一项临床研究(NCT02410733)中,对编码四种TAA(NY-ESO-1、MAGE-A3、酪氨酸酶和TPTE)的mRNA疫苗(BNT111)在晚期黑色素瘤患者中进行了评估(图2)。结果显示,3名患者对NY-ESO-1产生了T细胞反应,其中两名患者对MAGE-A3也有反应. 最近,BioNTech宣布与Regeneron进行战略合作,启动联合BNT111和Regeneron Libtayo(Cymplimab)的II期临床试验,用于治疗难治性/复发性、无法切除的III或IV期黑色素瘤患者。
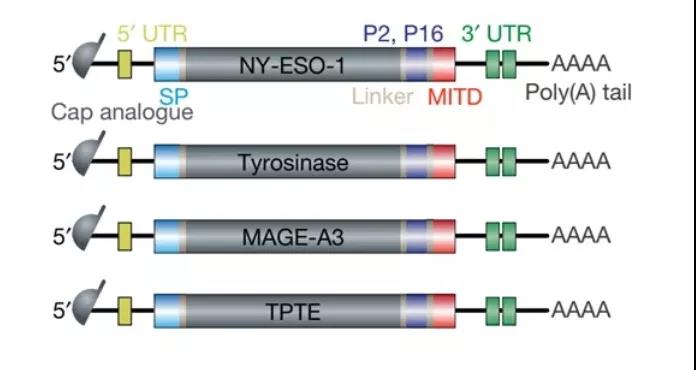
图2. 编码四种TAA(NY-ESO-1、MAGE-A3、酪氨酸酶和TPTE)的mRNA疫苗(BNT111)
另一个知名公司是CureVac AG。CureVac已研制出含有6种不同非小细胞肺癌TAA(MUC-1、Surviving、滋养细胞糖蛋白、NY-ESO-1、MAGE-C1和MAGE-C2)的mRNA疫苗CV9202。裸 TAA mRNA 疫苗与鱼精蛋白/mRNA 复合物共同递送。目前新的合作重点是CureVac的CV9202在早期临床开发中,与阿法替尼结合用于晚期或转移性表皮生长因子突变的非小细胞肺癌患者,以及结合化疗治疗无法切除的III期非小细胞肺癌患者。在第一项研究中,疫苗治疗耐受性良好,只观察到一些注射部位的反应和流感样症状。在大多数患者(84%)中观察到抗原特异性免疫反应增强。抗原特异性抗体和T细胞均升高,支持进一步研究基于mRNA的检查点抑制剂治疗非小细胞肺癌。
编码新抗原的mRNA疫苗:个性化疫苗
目前有几个障碍限制了TAA疫苗的进一步应用,包括:(1)仅对某些实体肿瘤确定了有限的TAA,从而限制了其应用;(2)TAA存在广泛的变异,导致免疫逃逸和产生耐药性,(3)正常组织中也存在TAA。针对TTA的疫苗可能会引发中枢和外周免疫耐受反应,从而降低疫苗接种效率。肿瘤特异性抗原,称为新抗原,现在是mRNA疫苗的核心靶点。新抗原来源于肿瘤细胞中的随机体细胞突变,而正常细胞中不存在。新抗原可以被宿主免疫系统识别为一个“非我”基序,因此是癌症疫苗的一个有吸引力的靶点.
开发个性化新抗原疫苗的第一步是鉴定和确认患者肿瘤中表达的特异性免疫原性非同义体细胞突变。癌症中的非同义体细胞突变,如点突变和插入缺失,可以通过比较肿瘤和匹配的健康组织的序列来识别。接下来,使用主要组织相容性复合体(MHC)I类表位预测算法筛选、分析和鉴定具有最高免疫原性的突变。基于体外结合分析结果进一步确认候选抗原的排序列表。以新抗原为基础的疫苗可以针对各种类型的变异突变。
目前正在进行多项临床试验,调查编码新抗原的mRNA疫苗的安全性和有效性。Moderna和默克公司合作开发了mRNA-5671,一种Kras个性化疫苗(编码KRAS新抗原),单独或与默克公司的PD-1抗体Keytruda(Pembrolizumab)一起用于治疗I期试验中的胰腺癌患者。用LNPs肌肉注射mRNA-5671,每3周一次,共9个周期。结果表明,该制剂具有良好的抗肿瘤免疫反应,总体耐受性良好。另一种产品是mRNA-4157,一种包裹在LNPs中的个性化疫苗,作为单一疗法或与Pembrolizumab联合使用(NCT03313778)用于治疗切除的实体肿瘤患者,包括黑色素瘤、膀胱癌和非小细胞肺癌,并显示出可接受的安全性以及显著的新抗原特异性T细胞反应. 据报道,接受单一疗法治疗的 13 名患者中有 12 名无疾病发生。BioNTech在该领域与Genentech合作,并在多个I期和II期临床试验中评估由Lipo-MERIT平台提供的mRNA个性化疫苗RO7198457的安全性和有效性。
小编总结
随着两种LNP mRNA疫苗最近被批准用于预防新冠肺炎,mRNA疫苗在癌症和传染病领域的临床前和临床研究中都经历了相当大的突飞猛进。mRNA已成为是一个功能强大、用途广泛的肿瘤疫苗平台。识别免疫原性TAAs/TSA和克服抑制性肿瘤微环境仍然是mRNA疫苗的主要障碍,但最近新抗原的发现和鉴定促进了个性化疫苗治疗的应用。编码新抗原的mRNA已成为个性化疫苗运动的领跑者。由LNP mRNA先驱BioNTech和Moderna领导的多项临床研究已经在多种实体肿瘤的临床试验中使用个性化疫苗展示了令人振奋的结果,开启了治疗性癌症疫苗的新纪元。

